植物初级生产力约占全球碳固定的一半。目前初级生产力的测量方法主要为两种:
卫星遥感:
在尽可能广泛的空间和时间尺度上运作
测量的PhytoPP误差较大
14C示踪法
最广泛使用的直接评价PhytoPP方法
操作的空间和时间尺度有限,导致极端欠采样
Chelsea Technologies的LabSTAF系统是在NERC资助的OCEANIDS计划(NE/P020844/1)中开发的。开发下一代更小、更节能、可部署的STAF系统在欧盟资助的海洋传感技术(TechOceanS)方案内仍在继续进行。我们目标是发展以STAF为基础的工具和方法来评估PhytoPP,与使用14C示踪剂方法相比,可以在更宽的空间和时间尺度上实现PhytoPP,并具有相当的准确度和精密度。
本文的目的是概述STAF荧光仪系统作为在空间和时间尺度上测量PhytoPP的平台,大大缓解了现有的采样不足问题。
目标平台包括:
科考船上的实验室及航行系统(LabSTAF)
大型自动驾驶平台,包括AutoSub LR和AutoNaut(AutoSTAF)
小型自主平台、滑翔机及Argo浮标(下一代STAF测量系统)
对于PhytoPP评估:
所有STAF系统的高动态范围(从极端寡营养到中营养)
高度自动化,基于STAF的PSII光化学通量(mol electrons m -3-3 s-1)测量
通过14C固定验证的STAF方法(mol C m-3-3 s-1)
总体目标:
尽量减少使用STAF生成 PSII光化学通量值时产生的误差
增加我们对决定因素Φe,C 的理解
STAF基础测量
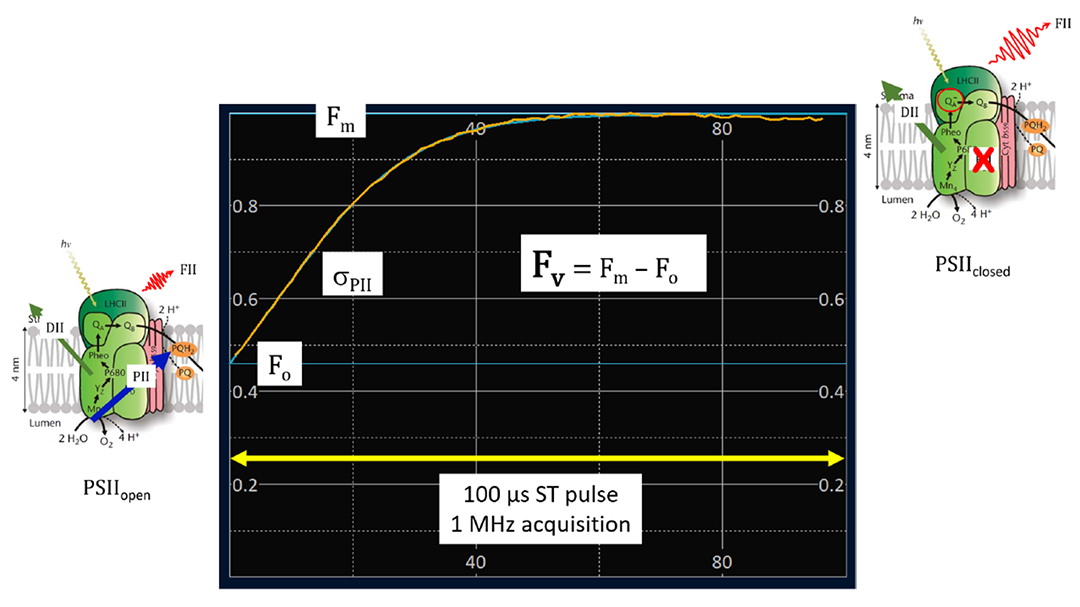
图1 所有的STAF仪器都采用了单周转(ST)方法,通常使用100 μs的LED 脉冲来使PSII光合作用达到饱和。被测量的样品体积小于总量的5%(10~20 ml)。被动式样品交换允许高测量频率,并在极端寡营养条件下提供高质量的数据。
在图1中,F v 是 “可变”荧光。Fo 和Fm分别是可变荧光的“初始 ”和“最大”荧光水平。σPII是PSII光化学的吸收横截面。在光照照射下,分别相当于Fq'、F'、Fm'和σPII'。尽管没有单位,但所有由STAF系统报告的荧光(F)值都是在校准的基础上。报告的σPII值单位为nm -2 PSII-1。
FLC生成rP-E曲线

荧光光曲线(FLC)包括在黑暗和饱和光之间的几个光合辐照度水平上进行的一组自动STAF测量。FLC生成的数据集可与基于14C示踪剂的光合作用光子辐照度(P-E)曲线相媲美。
图2 第一步数据处理生成相对光合作用光子辐照度(rP-E)曲线,其中rP值为入射光子辐照度与PSII光化学效率(ΦPII')的乘积。无量纲ΦPII'的值由Fq'/Fmc'算出。这里的报告rP单位为µmol photons m-2 s-1,表示PSII光化学通过1 m2σPII'的速率。
Fmc'中的“c”下标表示已应用基线校正(参见校正要求)。
一系列其他的STAF衍生的参数是由RunSTAF在FLC层面产生。在这个例子中,Fm'和τt'是由rP绘制。Fm'的下降通常伴随了PSII光化学的下调情况。τt' 时间常数跟踪PSII光化学的周转时间,报告单位为µs。
每PSII或每单位体积光化学通量
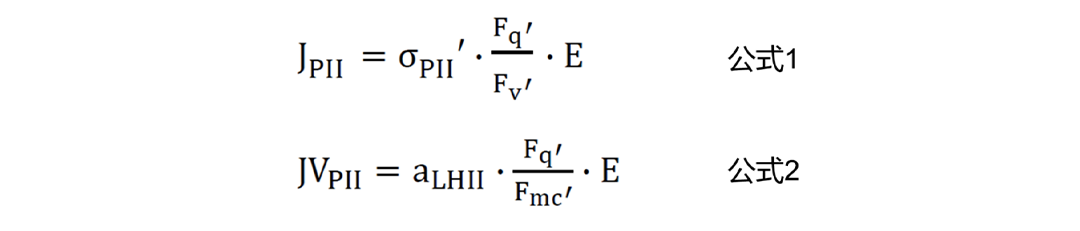
假设每个PSII光化学事件导致一个电子从氧转移到质体醌,rP的SI单位为mol electrons m-2 s-1。STAF系统允许将rP值转换为PSII光化学通量。每PSII光化学通量的SI单位为electrons PSII-1s-1,定义为JPII。每单位体积(海洋或其他介质)的光化学反应的SI单位为mol electrons m-3 s-1,定义为JVPII。RunSTAF采用Sigma方法生成JPII的报告值(公式1),采用吸收法生成JVPII报告值(公式2)。
Sigma方法和吸收法
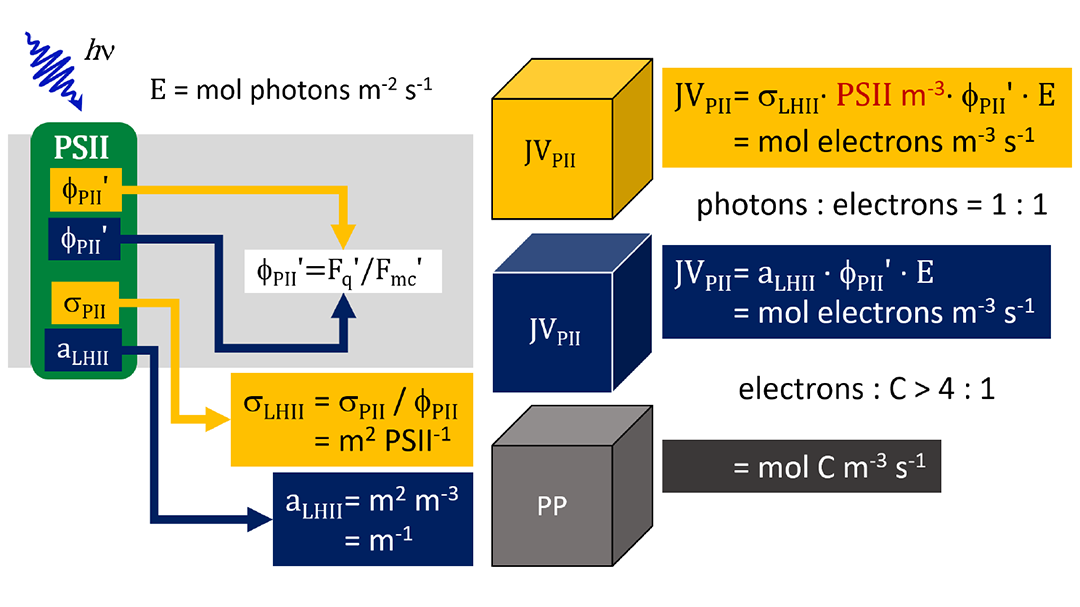
图3 Sigma方法可以从STAF数据中提供JPII(electrons PSII-1 s-1),不提供JVPII(mol electrons m-3 s-1)。将Sigma衍生的JPII转换为JVPII需要独立评估光化学活性浓度PSII m-3(图中以红色显示)。虽然吸收方法可以直接从STAF数据中提供PSII m-3,但将该值代入Sigma方程使其与吸收方程完全等价(包含的σPII值抵消了)。
校正要求
生成JPII和JVPII值需要光谱校正。生成JVPII还需要对包装效应进行校正(图5),并对基线荧光进行评估(图6)。谱校正需要精确测定用于提供ST测量脉冲和光化光LED的光子通量和光谱输出,以及样品的光化学激发曲线(PEP),打包效应校正是通过双波段测量最大和最小重吸收的荧光发射(10 nm半带宽,集中在685 nm和730 nm)来实现的。基线荧光校正适用于光失活PSII复合体积累导致的Fv/Fm测量值较低的情况。
使用PEP进行光谱校正
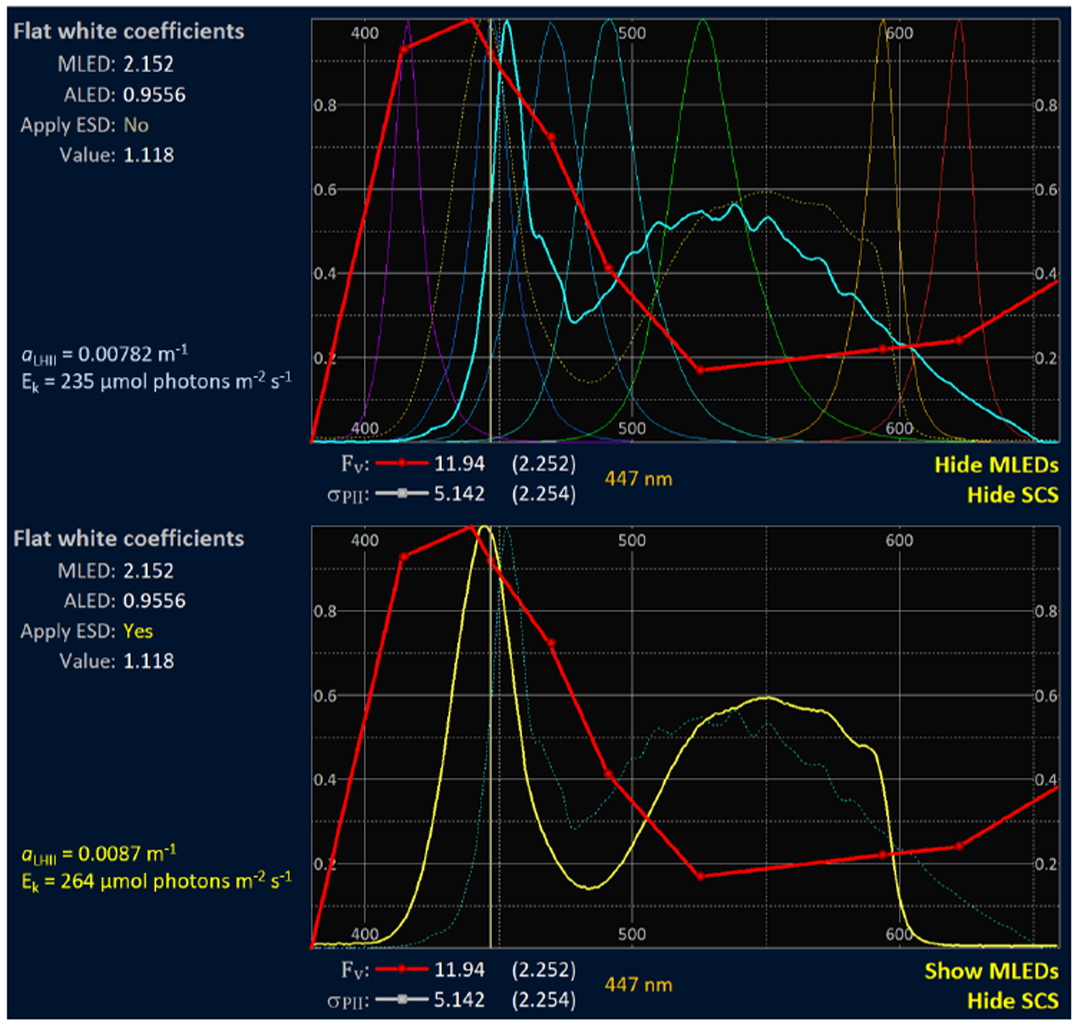
PEP的主要作用是便于对JPII和JVPII进行光谱校正。PEP数据是使用LED测量波段的不同组合产生的。RunSTAF由这些不同组合的ST曲线计算Fv和σPII值。Fv用于光谱校正。虽然生成PEP在技术上具有挑战性,但该过程是完全自动化的,通常不需要超过两分钟的测量。
图4 一个PEP曲线包括了416~622 nm的光谱。光谱校正光谱(SCS)的范围将Fv PEP扩展到380~660 nm之间。上部图中的红线显示了天然淡水样本的扩展PEP。LabSTAF内的光化LED的发射光谱显示为蓝色。图中还包括了七个LED测量波段的发射光谱。上部图中黄色虚线显示的是来自光化光源的一个发射光谱。添加此功能是为了方便比较STAF与14C固化平行测量的数据。在下部图中,来自光化光源的光谱已应用于LabSTAF数据集(应用ESD)。这将触发所有受影响参数值的重新计算,包括αLHII和Ek。αLHII的变化与JVPII是呈正比的(见公式2)。
打包效应修正

图5 使用STAF测量,荧光发射通常在685 nm测量。这为光化学活性PSII配合物和其它源的发射提供了最大的光谱区分。缺点是PSII对荧光发射的重吸收在该波段内接近最大值。在这个波段内,实际的重吸收水平取决于单个细胞的光学特性(封装效应)。在685 nm和730 nm测量的Fv的比率可以用来校正封装效应。通常,完全自动化的包装效果校正需要不超过30秒。
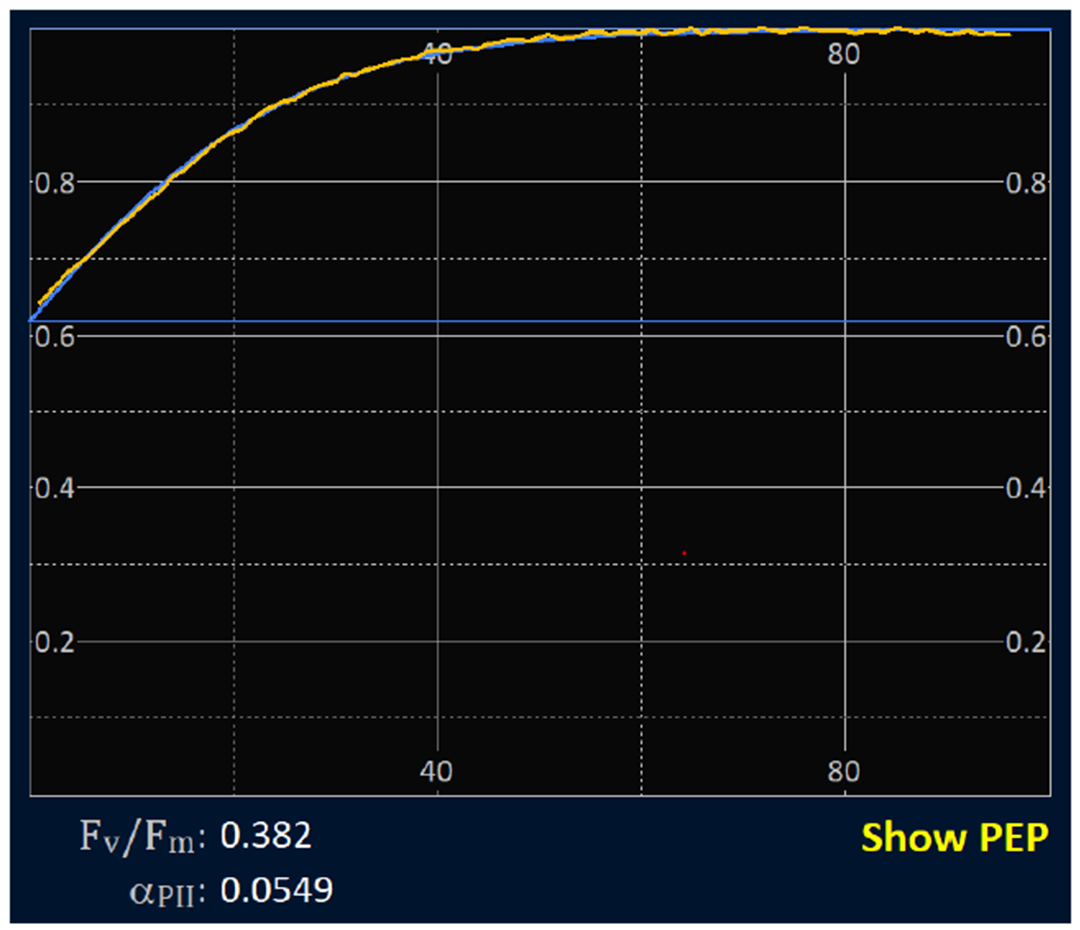
基线校正
图6 在此例中,ST脉冲应用于暗适应样品产生的Fv /Fm为0.382,这明显低于从“健康”暗适应细胞中广泛看到的0.5至0.65范围。这个较低的值可能是PSII光化学被抑制的结果,或者可能表明除了光化学活性的PSII复合体(包括光失活的PSII复合体)以外的其他来源的高水平荧光与在健康范围内的内在PSII光化学效率相结合。公式3可用于计算在假定的本征Fv /Fm(公式中的Fv /Fmc项)上的基线荧光(Fb)。

JVPII与14C固定的直接比较
需要对JVPII和14C固定进行平行测量,以了解控制它们之间可变比例的因素。迄今为止,方法上的不一致,包括孵育长度和光质量的差异,极大地抑制了电子碳比的实际评估(Φe,C值)。图7中的图像显示了LabSTAF单元用于运行JVPII和14C固定的“双重孵育”测量。LabSTAF内置的相对较大的样品室(25mm内径和56mm高度)便于进行此测量。14C加标样品包含在闪烁瓶(23毫米外径)。除了为两个测量提供单一的光化光源外,这种安排还允许在整个14C 的孵育期内进行STAF测量。

图7 LabSTAF内的大样品室允许使用闪烁小瓶,以方便使用单个光化光源(双孵化)平行测量JVPII和14C固定。左边的图是在北大西洋用天然浮游植物组合进行的一组双重孵化。 在这个示例中,Φe,C的范围从大约5到略高于7。这个范围比在以前的实验中观察到的要小得多,在以前的实验中,STAF评估率和14C评估率是并行测量的,而不是同时测量的。JVPII值包括RunSTAF软件中用于运行系统和处理数据的自动光谱和打包效应校正。
光化学激发光谱(PEP)
如上所述,PEP的应用是为了促进JPII和JVPII的光谱校正。RunSTAF计算Fv和σPII的波段特定值。虽然Fv PEP值在很大程度上不受样品内光谱异质性的影响,但σPII PEP值则不是。因此只有Fv PEP值用于校正JPII和JVPII。
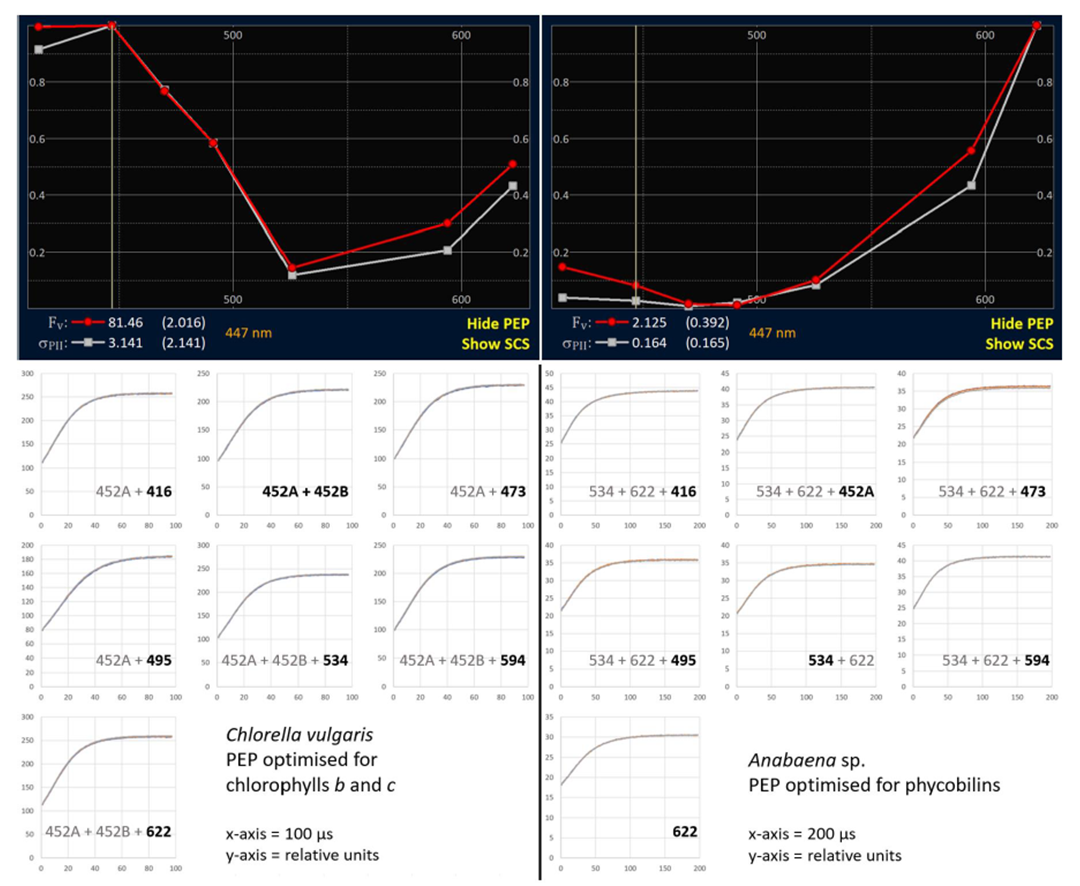
图8 PEP是通过平均用户设置的ST曲线数的每个组合波段来构建的。LabSTAF或AutoSTAF单元循环Steps列表,直到获得所需数量的曲线为止。使用LED的最佳组合可确保在ST脉冲期间关闭足够高比例的功能PSII复合体,以产生准确的Fv和σPII。
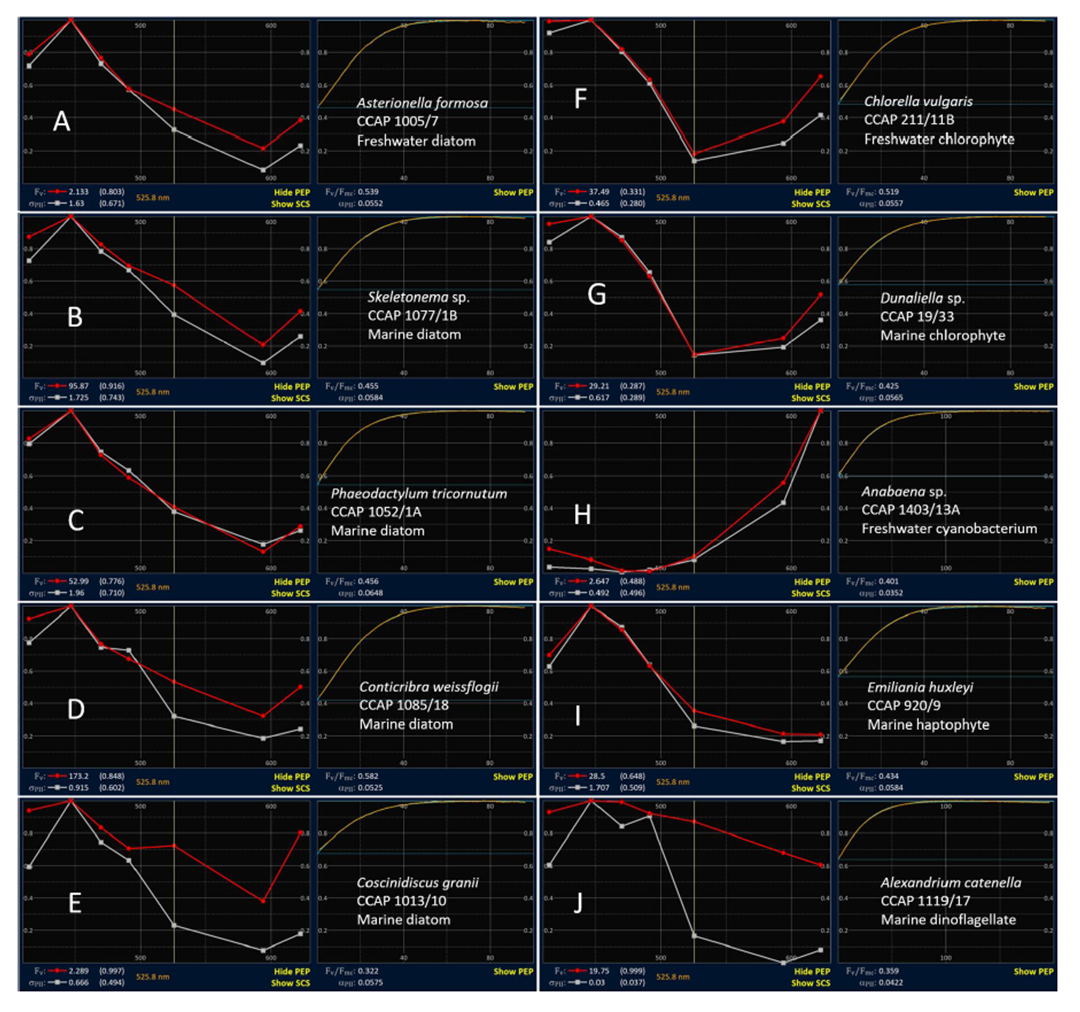
图9 10种浮游植物的代表性PEP + ST脉冲曲线。提供了一些Fv和σPII PEP示例。例子E和J显示了两种PEP之间最大的差异,并且可能包括蓝藻污染。
基线荧光
不来自于光化学活性PSII复合体的Fo部分被称为基线荧光,并被量化为Fb。基线荧光在包括JVPII在内的许多荧光参数的计算中引入了误差。图10中的数据图说明了基线校正对STAF衍生的PSII光化学评估与Clark型电极测量的总氧释放之间匹配的影响。

图10 氧光曲线(OLC)和荧光光曲线(FLC)同时测量一系列浮游植物物种。在~ 20 °C和30 µmol photons m−2 s−1的培养物上进行测量。FLC数据被标准化为O2的等效单位,OLC和FLC数据归一化为衍生的功能PSII复合体的浓度(O2 PSII−1s−1)。FLC数据使用KaFO(11800 m−1)或样品样本特异性(KaS)值获得。实线表示P-E曲线拟合。KaS值是通过对所有物种应用内在的Fv/Fm(Fv/Fmc)0.518生成的(公式4)。这些数据原发表于Boatman et al. 2019。
双ST脉冲测量
双ST脉冲(DSP)方法结合在这里描述的STAF系统中,跟踪序列第一个ST脉冲中关闭的PSII复合体的重新开放。ST脉冲通常具有相同的持续时间,它们之间的间隔是可变的(图11)。
图11 DSP序列在第一个ST脉冲施加前20 µs开始。在此信号偏移期间以及在第一ST和第二ST脉冲期间,数据以1MHz记录。在Gap或Sequence间隔期间不记录任何数据。
默认设置包含11个DSP,在第一个ST脉冲结束和第二个ST脉冲开始之间有400 µs到12800 µs的间隔。RunSTAF设置间隙序列,使得连续对之间的间隙持续时间的增加在整个集合中是恒定的。这个等差数列在下面的例子中很清楚,其中包含6个DSP,间隔在200 µs到6400 µs之间。
图12 从RunSTAF截图显示六个DSP对。目标样本是暗适应的。所显示的时间是间隔时间。括号内的数字是第一次和第二次ST脉冲之间可变荧光的回收率%。 RunSTAF对DSP数据集生成三个拟合,如图13所示。第一个是基于Fv(Fv)的简单恢复(图12)。第二和第三个拟合反应中心的重新开放,基于同质连通性(Rho)和PSII复合体的二聚化(Dimer)。这三条拟合的差异在黑暗中的最大,随光化光E的增大而减少。所有三种拟合包含一个快相和一个慢相。假设快速阶段主要是在第一个ST脉冲结束时,QB结合了质体醌或半质体醌的PSII重新开放,而慢相主要是在第一个ST脉冲结束时,RCII重新开放伴随一个空QB。ΔF和ΔS分别为弛豫相总振幅中属于快相和慢相的比例。τF和τS分别是快相和慢相的时间常数。
图13 复合屏幕截图显示了来自黑暗和两个光化水平样品的弛豫阶段的完整DSP数据集。公式5提供了所有三个拟合曲线的基本结构(Fv,Rho,Dimer)。对于Rho和Dimer拟合,F值替代开放阶段PSII的比例。
ST的PSII二聚体模型拟合
RunSTAF内的ST数据的二聚体拟合包括以下简单假设:·每个二聚体中的两个PSII反应中心是完美连接的(共享相同的光收集系统)。·二聚体间无连接性。
尽管这些假设对ST曲线拟合过程施加了很大的限制,“拟合度”通常非常接近限制性较小的Rho拟合,它允许PSII复合体之间的连接性浮动。如图14中DSP的示例包括了二聚体拟合。[oo],[oc],[cc]分别表示:两个PSII反应中心都打开,一个打开一个关闭,都关闭。
图14 暗适应样品的DSP说明了二聚体的拟合。第一次ST脉冲的结束和第二次脉冲开始的间隔为800 μs。图中显示的[oo],[oc],[cc]比例为第一次脉冲(黄实线)选择点的数据。第二个ST脉冲上的[oo], [oc]和[cc]线的起点假设在两个ST脉冲间隙的[oc]或[cc]内重开封闭PSII反应中心的概率相等。
ST脉冲诱导σPII2的猝灭
从DSP方法的应用中,一个一致而令人惊讶的观察结果是σPII的快速瞬态下降,使得第二个ST脉冲值(sσPII)比第一个ST脉冲值低50%(图15)。这种减少的“恢复”时间低至数百µs,这种恢复的动力学(图16)与PSII复合体之间的连接性的一致仅限于二聚化。
图15 从RunSTAF数据屏幕中裁剪在FLC的第一步中σPII ('), sσPII (')和Fm(')的变化。FLC的第一步白色方块中的数字是入射E(µmol photons m-2s-1)。sσPII (')中的振荡跟踪每个DSP期间的间隙步进。
假设在封闭的PSII络合物中电荷分离是最好避免的,PSII的二聚化可以被视为光保护。 保护是提供给一个封闭的PSII在一个开放加封闭(oc)二聚体,仅仅是因为一个被吸收的光子在开放的PSII上比在封闭的PSII上更容易导致电荷分离。
ST脉冲后观察到的σPII降低也可能反映了双闭合(cc)二聚体内的光保护过程。工作假设是,在DSP测量中观察到的σPII明显下降50%,反映了在cc二聚体形成后的最初几百µs内,需要两个光化学事件来关闭打开的PSII。反过来,假设这一要求表明在封闭的PSII中存在一个在该时间尺度上起作用的去激励途径。虽然这条通道只能在相关的时间范围内运行一次,但提供了保护(相对于在大多数情况下已经不常见的事件)可能非常有效。
上海奕枫仪器设备有限公司 CopyRight 2009-2019 All Rights Reserved. 沪ICP备07031178号